라이브러리
다양한 자료를 통해 업계 인사이트 및 당사 서비스에 대해 자세히 알아보세요.
당사는 분야별 전문가를 보유하고 있으며 약물 생산 및 임상시험 업계 전반에서 기술 및 과학 전문가들과 함께 분자부터 약품까지 모든 개발 단계를 설명하는 whitepaper, 기사, 웨비나 등 다양한 자료를 제공합니다.
메뉴 버튼을 사용하여 검색 범위를 지정하거나 아래 필터를 사용하여 카테고리, 분야별 전문가 또는 콘텐츠 유형별로 전체 라이브러리를 검색할 수 있습니다.
문의 사항이 있으신가요? 문의하기
관심 분야를 선택해 주세요.

Fact sheet
빠른 임상 1상 진입을 위한 Path to IND 바이오 약물 개발 가속 솔루션
Path to IND for biologics 플랫폼을 이용하면 고분자 약물을 transfection 시작 후 최단 9개월만에 FIH 임상에 투여할 수 있도록 지원합니다

Understanding large molecule drugs
이 블로그에서는 바이오 의약품에 대해 심층적으로 살펴보며, 그 주요 특성, 장점과 과제, 그리고 제약 산업에서의 미래를 다룹니다.
18 minute read

Event
Tradeshow
Interphex Japan 2025
Connect with Thermo Fisher Scientific at Interphex Japan 2025 from July 9 to 11 to explore how we accelerate your drug development journey to global market.
Seminar
Seminar
Path to IND: 신속한 글로벌 임상 진입과 규제 변화 대응 전략 세미나
신속한 임상 진입과 글로벌 성공을 위한 규제 변화 대응 전략을 논의하는 Patheon 바이오 세미나에 초대합니다.

Event
Tradeshow
BIO International Convention
Join us in Boston at BIO International to explore how we can support your biologics program from early decisions through IND readiness and beyond.

Partnership-driven value in drug development: Compelling insights from new research
Partnering with a single vendor for comprehensive drug development, manufacturing, research, and clinical supply services can accelerate trial starts and substantially reduce development costs. New research by the Tufts Center for the Study of Drug Development analyzed the impact of integrated service models on oncology drug programs and showed significant reductions in development timelines across clinical phases while improving cost efficiency.
15 minute read

Event
Conference
Festival of Biologics 2025
Visit Thermo Fisher Scientific at booth #773 from April 23 – 24 to discover our cutting-edge new platform that accelerates biologics drug development like never before: Path to IND for biologics.

Event
Tradeshow
Bio Korea 2025
5/7부터 3일간 개최되는 바이오코리아 2025에 초대합니다. 당사 부스를 방문하고 글로벌 CDMO와의 전략적 파트너십에 대해서 자세히 알아보세요.

Tech transfer, part 1: 의약품 생산 불확실성 극복하기 - 기술 이전의 핵심 역할
효율적인 기술 이전은 제품 품질 유지, 지적 재산 보호, 비용 관리, 및 생산 규모 확대를 지원하여, 제약 기업이 새로운 기회와 도전에 효과적으로 대응하고 경쟁력을 유지하며, 환자에게 지속적인 의약품 공급을 보장할 수 있도록 합니다.
15 minute read

5,000L 싱글유즈 바이오리액터(Single-use bioreactor)의 바이오의약품 생산 혜택
바이오의약품 생산에서 생산 용량 평가 방법, 각 신약 개발 단계에서 싱글유즈 바이오리액터를 활용하는 이점에 대해 소개합니다.

Event
Tradeshow
NextGen Biomed 2025
Let’s connect at NextGen Biomed 2025 in London to discuss how our CDMO and CRO solutions support biotech companies of all sizes and stages in advancing their life-changing treatments.

Event
Tradeshow
DCAT Week 2025
Book a meeting with us at DCAT to explore how our CDMO and CRO services can help emerging biotech and large pharma companies deliver therapies to patients faster.

Event
Conference
Festival of Biologics 2024
Join us at Festival of Biologics to meet our experts and see how our integrated CDMO services can support your biologics needs.

Event
Tradeshow
Bioplus Interphex Korea 2024
Thermo Fisher Scientific이 7월 10일~12일 코엑스에서 개최되는 BIX 2024에 참가합니다.

Event
Tradeshow
Bio Korea 2024
5/8부터 3일간 개최되는 바이오코리아 2024에 초대합니다. 당사 부스를 방문하고 글로벌 CDMO와의 전략적 파트너십에 대해서 자세히 알아보세요.
Infographic
빠른 IND/IMPD를 위한 5가지 방법
품질을 유지하면서 향후 상업화 목표에 차질 없이 IND/IMPD에 빠르게 도달하는 방법은 무엇일까요? 인포그래픽을 통해 초기 개발 프로세스를 최적화하는 방법에 대한 당사 전문가들의 제안을 확인하세요.

Webinar
EU 규제 환경 탐색: 의약품 개발, 치료 혁신 및 시장 접근성 가속화 전략
총 3부로 구성된 이 웨비나 시리즈에서는 성공적인 인허가를 위해 기업이 의약품 개발 과정에서 염두에 두어야 할 주요 영역을 다룹니다.

Event
Tradeshow
DCAT Week 2024
Join us at DCAT Week in New York City where will be discussing the elements of a trusted partnership and what’s needed to ensure your project goes smoothly.

Article
[인터뷰] 써모 피셔 사이언티픽 "호주 파테온 CDMO, 韓 신약 세계화 교두보"
호주 브리즈번 바이오 DS 생산시설 대표의 인터뷰를 통해 당사 브리즈번 사이트의 역량과 한국 기업의 바이오 의약품 생산 사례 등에 대해 자세히 알아보세요.

Blog post
CDMO 파트너를 선택할 시 고려해야 할 7가지
CDMO가 제약사와 협력하는 방법에 대해 알아보고 기업이 CDMO 파트너를 선정할 때 고려해야 할 주요 고려사항에 대해 확인하세요.
9 minute read

Blog post
CRDMO - CRO/CDMO 통합을 통한 의약품 개발의 재구성
의약품 개발사는 통합 CRO/CDMO와 협력함으로써 여러 아웃소싱 파트너와 협력해야 하는 복잡함 없이 새로운 치료법을 시장에 출시하는 과정을 보다 효율적으로 탐색할 수 있습니다. 통합 CRO/CDMO와 협력할 때 얻을 수 있는 이점에 대해 알아보세요.
9 minute read
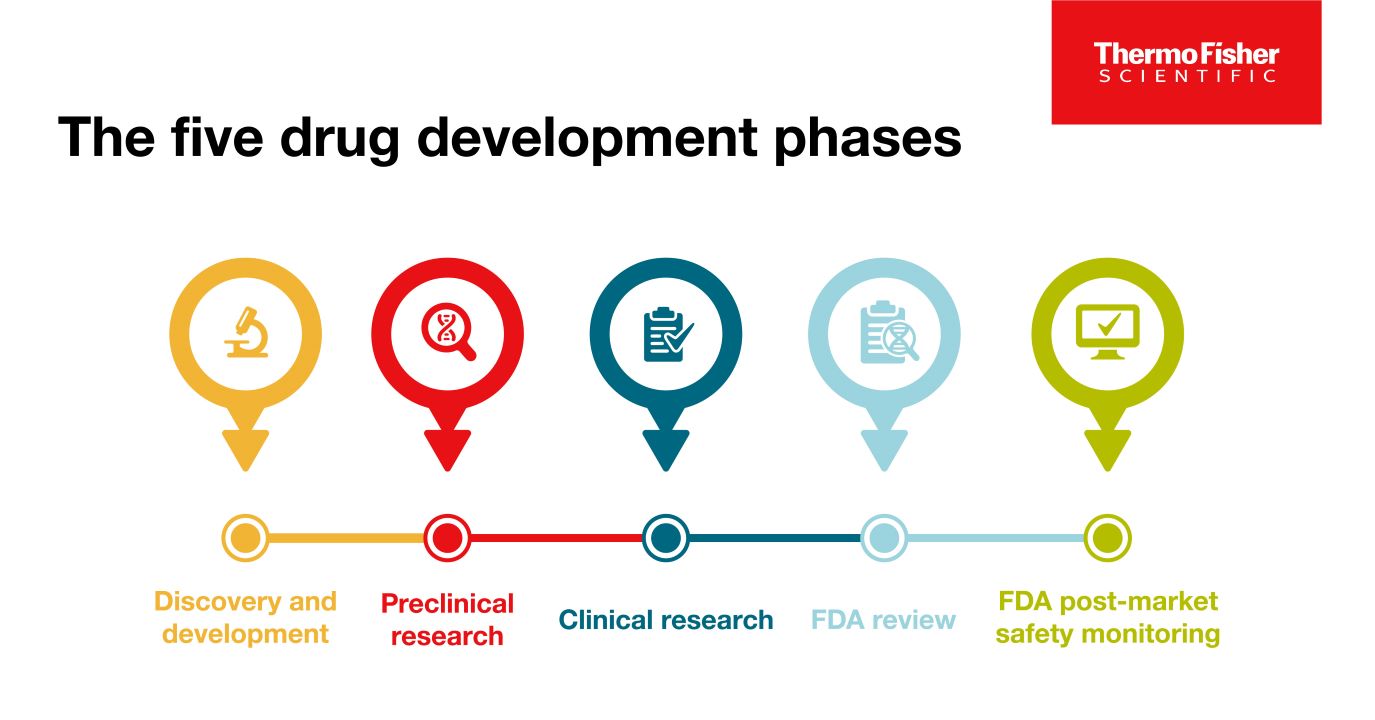
Blog post
약물 개발의 5단계
성공적인 상업화를 위해서, 모든 약물은 1) 약물 발견 및 개발 2) 전임상 연구 3) 임상 연구 4) FDA 검토 5) 안전성 모니터링의 5가지 특정 단계를 통과해야 합니다.
9 minute read

Blog post
CRO / CMO / CDMO 차이점
CRO, CMO, CDMO는 모두 약물 개발 및 제조와 관련된 서비스를 제공합니다. 자료에서는 이 세 조직과 서비스의 차이점을 설명합니다.
9 minute read

Blog post
통합된 업무 프로세스를 통한 디지털 업무 환경 조성
안정성과 경험이 중요한 물리적 업무 환경과는 대조적으로, 디지털 업무 환경은 혁신과 연결성에 초점을 맞춥니다. 자료를 통해 디지털 업무 환경 조성에 대한 자세한 내용을 확인하세요.
4 minute read
인포그래픽
바이오의약품 상업화 - 위험을 줄이고 결과를 최적화하기 위한 전략 이해하기
실험실에서 완제의약품의 최종 생산까지, 약물 생산에는 여러 단계의 공정이 발생합니다. 각 단계마다 서로 다른 전문가들이 개입하므로 다양한 작업이 동시에 진행되는 프로그램을 원활하게 진행하려면 계획 및 검증된 실행 접근법이 필요합니다.

Whitepaper
품질에 대한 종합적인 이해를 통한 CDMO 파트너십 개선하기
CDMO의 품질을 판단하기 위한 주요 지표와 고객-CDMO의 파트너십을 지속적으로 개선하고 협력을 강화하여 궁극적으로 신뢰 관계를 구축하기 위한 도구와 모범 사례를 설명합니다.

Fact sheet
Early Development Solutions
의약품의 초기 단계 개발에서는 기업 규모와 관계없이 모두가 빠르고 비용 효율적이며 과학적 근거가 충분한 통찰을 얻는 것이 중요합니다...

Blog post
Keeping your information safe: IP and data protections in China and across the globe
Experts at Thermo Fisher discuss rigorous contractual, project team, and data protections that are in place to keep customers’ intellectual property and confidential information secure.
12 minute read

Blog post
Manufacturing in China for China: Navigating the regulatory landscape
Experts at Thermo Fisher provide insight into the registration and approval pathway for developing and marketing biologic therapies in China for the domestic market.
12 minute read

Bioplus Interphex Korea 2023
Thermo Fisher Scientific이 7월 12일~14일 코엑스에서 개최되는 바이오플러스-인터펙스 코리아에 참가합니다.

Bioplus Interphex Korea 2022
Thermo Fisher Scientific이 BIX 2022에 참가합니다.
일시: 2022년 8월 3일 ~ 5일
장소: 코엑스 Hall A
부스번호: E10 Thermo Fisher Scientific

Webinar
Gateway to China: Developing Biologics for the fastest-growing patient population on Earth
중국은 미국에 이어 세계에서 두 번째로 큰 제약 시장으로, 2021년 약 12%의 세계 시장 점유율을 차지합니다. 인구 고령화와 새로운 적응증의 확대로 중국은 모든 바이오 제약 회사에게 매력적인 시장으로 인식되고 있습니다.

Whitepaper
기술이전, 위험은 축소하고 혜택은 확대하는 방법
2020년 당사는 181건의 기술 이전을 성공적으로 마무리함으로써 고객의 공급 확보, 유통 개선, 프로그램 비용과 위험 절감을 지원했습니다.

Blog post
Ensuring Quality Consistency at Hangzhou Site
Find Q&A insights from experts at Thermo Fisher on the quality systems framework that guides quality implementation at our new Hangzhou site.
12 minute read

Blog post
Top tips for providing the right amount of detail in first-in-human common technical documents
In the early-development stage, little may be known about a drug’s characteristics. What’s more, drug processes and formulations frequently evolve as more information emerges following testing and trials. Learn more.
5 minute read

Blog post
Choosing a CDMO Who is a True Bioproduction Expert
With the number of CDMO’s rising in the biologics manufacturing industry, it can be challenging for new and emerging biopharmaceutical companies to determine which CDMO is right for them.
8 minute read

Blog post
Prefilled Syringes: Three Pain Points You May Not Have Considered
As pharmaceutical companies look to become more patient-centric, certain drug products come to the forefront to support that effort.
5 minute read

Blog post
Work Smarter, Not Harder: Accelerating Your Biologics Development and Commercialization
Over the past decade, the biologics industry has seen double digit growth and an overall increase of market share.
5 minute read

Blog post
COVID-19’s Silver Lining: Accelerated Vaccine Development
Vaccine development is a lengthy process—it is expensive, attrition is high, and to get a licensed vaccine to everyone, it takes multiple candidate iterations. Vaccine development for pandemics and epidemics is risky, and due to the novel nature of viruses, certain unknown factors can derail a vaccine program.
6 minute read

Blog post
Navigating the Complexities of Process Performance Qualification
Method qualification is monumentally important before process performance qualification (PPQ). This early assessment of your method’s performance characteristics is critical as it pertains to method validation and its parameters such as precision, accuracy, and linearity.
5 minute read

Whitepaper
Accelerating Biopharmaceutical Development with Strategic CDMO Partnerships
불확실성이 증가하는 변혁의 시기에 바이오 의약품 개발을 성공으로 이끌기 위해서는 변화의 원동력이 되는 과학, 기술, 시장의 변화를 이해하고 이에 맞는 전략을 도입해야 합니다.

Whitepaper
What You Need to Know About Process Characterization and Validation For Biologic Processes
지난 20년 간 바이오의약품 업계 성장의 주요 요인은 단클론 항체(mAb)를 이용한 지속적인 혁신이었으며, 현재 mAb는 전체 바이오 치료제의 50% 이상을 차지하고 있습니다.

Whitepaper
Top five risks facing your small biopharma clients
바이오 제약 기업은 한정된 예산과 시간이라는 리스크가 높은 개발 환경에 놓여 있습니다. 압박이 심한 환경에서 기업은 향후 일정을 지연시키거나 또는 개발 중단을 일으킬 수 있는 중요한 요소를 간과하는 경향이 있습니다...

Whitepaper
Telltale signs you’re with the wrong CDMO
신약 개발 후기 단계에서는 상업화가 추진되면서 프로젝트에 많은 변경이 발생하기 마련입니다. 이런 중요한 시기에 기업은 벤더를 평가하여 상업화를 위한 옵션을 분석하게 됩니다. 상업화를 위한 스케일업 단계에서 당신의 CDMO가 실제로 힘이...

Whitepaper
Quality by Design: A Holistic Approach to Drug Development
바이오 제약 산업의 발전이 계속됨에 따라, QbD (Quality by Design)는 약물 개발 및 생산에 대한 포괄적이고 선제적인 접근 방식으로 핵심 프로세스를 혁신하고 있습니다....

Whitepaper
Rise in Targeted Therapies Drives Need for Small-Volume Manufacturing
바이오 의약품 시장은 지난 15년간 꾸준히 두 자릿수 성장세를 보였으며 현재는 전체 FDA 신약 승인 건의 4분의 1 이상을 차지하고 있습니다. Evaluate Pharma의 희귀의약품 프로젝트에 관한 2017년 보고서에 따르면...

Whitepaper
Technology Transfers: Reaping Rewards, Reducing Risks
2016년 Patheon은 111건의 기술 이전을 성공적으로 마무리함으로써 고객의 공급 확보, 유통 개선, 프로그램 비용과 위험 절감을 지원했습니다. 기술 이전 과정에서 고객사는 Patheon의 전문지식, 안정적인 공정, 표준화된 작업 절차와 장비를 활용...

Whitepaper
Multiplexing: Managing risk with proven, single use solutions
기업은 신약 출시에 막대한 자본을 투자하면서 마찬가지로 큰 위험을 감수하게 됩니다. 일반적으로 신약의 대규모 생산 역량을 마련하는 데에는 3~4년이 소요되므로 임상 3상이 완료되기 전에 생산량을 결정해야 합니다...

Whitepaper
Is Your In-House Strategy Ready for the Uncertainties of Biologic Drug Development?
블록버스터 약물에 대한 과거 제약업계의 의존성은 소규모 환자 집단의 충족되지 않은 요구를 처리하는 약물 개발에 초점을 맞추는 것으로 진화했습니다.

Whitepaper
In-House Versus Outsource: A Decision-Making Guide
바이오 의약품 시장은 블록버스터 의약품 생산에서 미충족 수요의 치료제를 연구하는 틈새시장으로 이동하고 있습니다. 이로 인해 경쟁이 심화되고 개발 일정이 촉박해지며 역량 부족의 문제가 대두되는 등 후보물질의 성공적인 개발을 방해하는 여러 위험 요소가 제기되고 있습니다...

Whitepaper
Full throttle for vaccine filling
팬데믹 기간동안 업계는 비즈니스 지속성, 신속한 상업화, 공급망 효율성을 모두 달성할 수 있도록 급변하는 환경에 빠르게 적응해야...

Whitepaper
Rising to the rare disease challenge: Key considerations in large-molecule orphan drug development
희귀의약품은 소규모 제조, 한정된 시간/데이터, 적은 시료 규모, 비용 때문에 신약 개발 분야에서도 특히 더 어려운 도전 과제입니다. 다음을 통해 이런 어려움을 극복하는 방법에 대해 확인하세요....

Whitepaper
Challenges and Practical Solutions for Switching to Prefilled Syringes for Injectables
개발 및 임상 단계에서 바이알 등 다른 제품 형태를 사용한 후 상업용 의약품 출시에 앞서 사전 충전형 주사기로 전환하는 경우가 있습니다. 제형 전환은 새로운 투자를 요구할 뿐 아니라 환자와 이해당사자들에게 개선된 결과를 가져오므로...

Whitepaper
Biologic drug products: A 5-point strategy for building a robust CMC dossier
후보물질의 성공적인 개발과 생산을 위해서는 개발 초기부터 CMC의 규제 지침을 이해하고 자료를 철저히 준비하는 것이 매우 중요합니다...

Whitepaper
Analytical Considerations For Biopharmaceuticals During Commercialization
의약품의 품질과 안전성을 보장하려면 적격성평가(PPQ) 전에 분석 방법을 검증해야 합니다. 또한 의약품이 규제 기관의 품질 기준을 충족한다는 것을 입증하기 위해서는 높은 수준의 재현성과 정확도를 갖춘 강력한 분석 방법이 필요...

Whitepaper
Sterile formulation strategies to shorten timelines for first-in-human studies
최근 몇 년 동안 희귀의약품, 빠른 임상 종료점을 가진 적응증에 대한 임상 후보물질이 늘어나면서, 후기 임상 단계로의 경로가 짧아지고 가교 연구를 수행할 시간이 줄어들었습니다. 따라서 보다 확장 가능한 제형 개발에 대한 필요성이 대두되고 있습니다....

Whitepaper
Impact of a pandemic outbreak on vaccine development approach
백신을 개발 과정에는 많은 장애물이 존재합니다. 그러나 팬데믹 기간 동안의 백신 개발에 있어서는 기존의 제조 방식으로는 해결할 수 없는 고유의 복잡한 문제가 존재합니다. 지난 10년간 H1N1 인플루엔자, 사스-코로나바이러스(Sars-Cov), 에볼라, 메르스의 발생은...

Whitepaper
5,000L single-use bioreactors: The next generation in biologics manufacturing
글로벌 바이오 의약품 시장과 연구 발전의 지속적인 확대에 따른 치료제 수요 증가는 바이오 의약품과 바이오시밀러 포트폴리오 확대를 가져왔습니다...

Infographic
A practical guide to writing robust chemistry, manufacturing, and controls dossier modules to support first-in-human trials
인간 대상 첫 임상시험의 확고한 근거가 되는 CMC 작성을 위한 실용적인 가이드를 소개합니다.
Infographic
The unrealized value of a combination drugs strategy
임상적 장점으로 고정 용량 복합제(FDC) 인기가 높아지고 있습니다. FDC는 비즈니스 관점에서도 기업에 혜택을 제공하기도 합니다. 인포그래픽을 다운로드하여 자세한 내용을 확인하세요.

Infographic
Made with proof & purpose
최신 인포그래픽을 통해 고객의 후보물질을 성공으로 이끄는 Thermo Fisher Scientific의 역량을 확인하세요...

Infographic
A Tale of Two Molecules
용해도가 낮은 의약품을 위한 최적의 솔루션은 무엇일까요? 두 후보물질은 모두 동일한 증상을 치료하기 위해 고안되었으며, 모두 용해도 문제가...

Infographic
Four special fill/finish considerations for vaccine production
백신 생산 준비가 완료된 후에는 처리 및 충전/완제 공정에 관해 고려해야 할 중요한 문제가 있습니다. 올바른 선택은 백신의 안정성과 순도를 보장할 뿐만 아니라 불필요한 낭비와 비용도 줄입니다...

Infographic
Top strategic tips for filing a successful IND with speed and efficiency
IND, IMPD 성공적인 신청을 위한 8가지 팁을 소개합니다...

Infographic
Small Pharma, Big Opportunity: Should CDMO Partner Size Influence Selection for your Large Molecule Project?
초기 개발 과정에서 리소스 제약과 공정 개발 문제로 인해 기업은 위탁 개발, 생산을 찾는 경우가 많습니다. 특히 신생 바이오기업은 CDMO 규모를 결정하는 데 있어 어려운 결정을 내리는 경우가 많습니다...

Infographic
10 Reasons Formulation Complexity is on the Rise in Steriles
초기 개발 기간에는 제제의 복잡성 등 의약품 연구를 다음 단계로 진행하는 데 방해가 되는 다양한 도전과제가 존재합니다. 다양한 요인으로 인해 무균 주사제 개발의 복잡성은 점점 더 증가하고 있습니다. 특히 이는 업계 전체가 다음 이슈에 중점을 두고 발전하기 때문에 발생하는...

Webinar
Benefits of 5KL Bioreactor When Outsourcing Late-phase Biologics Drug Substance Manufacturing
현재 업스트림 바이오 공정에서는 두 가지 중요 요소가 주목을 받고 있습니다. 첫째는 바이오리액터의 용량, 특히 혼합과 물질 전달 성능 개선에 대한 과제를 제기하는 강화된 세포 배양 공정 입니다...

Webinar
Accelerating Cell Culture Development through Practical Application of Innovation Technologies
상업화 니즈에 있어서의 변경뿐 아니라 바이오의약품 파이프라인의 변경에 따라서도 사용하는 기술과 세포주 개발 워크플로우가 변경될 수 있습니다. 혁신적인 기술을 통해 보다 빠르고, 효율적이고, 규제에 대비한...

webinar
FIH (First-in-Human) strategy for reducing the development period of oral and injection drugs for clinical use
기업은 초기 개발 시 일정 지연을 자주 겪곤 합니다. 적합한 솔루션을 활용하면 속도, 품질, 위험완화 사이의 균형을 유지하면서 개발 일정을 단축할 수 있습니다.

Webinar
Practical Implementation of Innovative and Scalable Technologies to Accelerate Biologics Development and Commercialization: A CDMO Perspective
웨비나를 시청하시고 혁신적인 신기술과 최고의 생산 역량을 토대로 바이오의약품 개발 시 발생하는 문제를 해결하는 방법을 확인하세요.

Webinar
Leveraging Innovative Technologies, Best Practices and Strategies to Accelerate Biologics Development and Commercialization
웨비나에서는 다중 속성 방식,고수율 세포주 및 자동화 시스템을 활용한 현대화된 세포주 개발 워크플로우, 차세대 정제 레진과 같은 혁신적인 기술이 바이오 의약품의 개발과 상업화를 가속화하는 데 어떤 도움을 줄 수 있는 지 설명합니다.

Webinar
Biopharmaceutical development opportunities and benefits in Australia
연구개발 비용에 대한 세제혜택과 호주의 신속한 임상시험 인허가 제도로 신약개발을 위한 해외 임상시험 국가로 호주를 선택하는 바이오 기업들이 증가하고 있습니다.

Webinar
Vaccine Development: Strategic Approach & Response During Pandemics
지난 10년간 H1N1 인플루엔자, 사스-코로나바이러스, 에볼라, 메르스의 발생은 기존의 백신 개발 방법에 대한 몇 가지 논의를 불러 일으켰습니다. 사스-코로나바이러스-2의 확산이 심화되면서 과학자들은 제약사와 함께 품질이나 안전성, 효능에 영향을 미치지 않고...

Webinar
Stabilizing your supply chain in times of global volatility
완제의약품을 적시에 제조하여 환자에게 공급하려면 안정적인 공급망이 있어야 합니다. 그러나 글로벌 경제가 전쟁, 기후변화, 노동력 부족으로 불확실성이 증가하면...

Webinar
Orphan Drugs: Balancing Financial Incentives & Complex Challenges
희귀의약품은 환자 수가 적은 것에 비해 개발과 출시 비용은 높습니다. 고위험 틈새 시장임에도 불구하고 희귀의약품은 신약 개발 시 받게 되는 금전적 인센티브와 혜택 때문에 시장 규모가 증가하는 추세에 있습니다...

Webinar
Manufacturing Innovation: The Case for Continuous Manufacturing
CDMO가 경구제의 연속 생산 공정을 제공함에 따라 이 제조 기술을 활용하고자 하는 기업은 과거와는 다른 비즈니스 케이스를 확보할 수 있게 되었습니다. 최근까지만 해도 기업이 상업 생산 공정에 연속 생산을 도입할 수 있는 유일한 방법은 초기에 상당한 자원을 투입하여 기술 역량을 개발하는 것이었습니다...

Webinar
Leveraging Infrastructure Investments and Innovation to Accelerate Biologics Development
바이오의약품과 재생의료 치료제의 파이프라인이 성장하고 새로운 바이오의약품 및 바이오시밀러 승인 속도가 빨라지면서, 큰 잠재력을 가진 후보물질을 성공적인 치료제로 전환할 수 있는 솔루션이...

Webinar
How Adaptable Manufacturing Models are Paving a Steady Path into an Unpredictable Future
In a short 20 minutes, you can learn about manufacturing trends, adaptable manufacturing models, and take a tour of Pacira’s condominium manufacturing facility at Patheon’s Swindon location.
Webinar
Highly potent strategies from early development to commercialization
제약 R&D 분야는 과거 어느 때보다도 특수 의약품 개발에 집중하고 있으며 그로 인해 고효능 API가 늘어나고 있습니다. 이에 따라 지난 몇 년간 고효능 의약품 제조가 꾸준히 늘고 있으며 이런 동향은...

Webinar
Getting from R&D to IND – Pitfalls to avoid and how to succeed
IND까지의 개발 과정에는 언제나 어려움이 따릅니다. 개발 속도, 위험 완화, 미래의 가치 사이의 균형을 맞추는 것은 쉽지 않습니다. 향후 스케일업과 상용화를 위한 안정적인 기반을 확보하는 동시에 위험 완화와 일정 단축 사이의 균형을 찾아 후보물질에서 FiH 임상시험까지 진행...

Webinar
From Patient Adherence to Manufacturing Ease—Why Softgels Make Sense for Rx
연질캡슐은 처방약에서 많이 사용되는 제형은 아닙니다. 제약사는 처방약에 있어 정제와 캡슐을 주로 개발하는 경향이 있습니다. 그러나 연질캡슐은...

Webinar
Entering first-in-human clinical trials: A five point strategy for building a robust CMC dossier
생물학적제제로 최초 인체 대상(FIH) 임상시험을 수행하기 위해서는 이러한 복잡한 고분자 물질 특유의 과학적/규제적 문제들에 대한 깊고 미묘한 이해가 요구됩니다...

Webinar
Going global: The impact of US foreign trade zones on drug product manufacturing costs and timelines
오늘날과 같은 글로벌 경제에서는 세계 전역에서 의약품 원료를 소싱할 수 있습니다. 이런 원료 수입은 큰 비용을 수반합니다...

Webinar
Choosing the Right CDMO for Late Phase Clinical Trials
임상 단계를 거치면서 광범위한 역량과 풍부한 경험을 보유한 파트너와 협업해야 하는 이유와 이점에 대해 확인...

Webinar
Building a robust FIH biologics regulatory CMC package
후보물질이 임상시험 단계에 진입할 때는 반드시 임상시험 수행을 뒷받침하기 위한 서류를 준비해야 합니다. 이 서류의 필수 요소는 후보물질의 화학(Chemistry), 제조(Manufacturing), 품질관리(Controls)를 보증할 수 있는 CMC 패키지...

Webinar
An optimized approach to drug development
Thermo Fisher Scientific의 Quick to Care™ 프로그램을 활용하면 원료의약품과 완제의약품 개발, 수요 계획, 임상 공급을 단일 맞춤형 솔루션에 통합하여...

Webinar
Advanced therapies and large molecule investments
바이오의약품, 세포/유전자 치료제, 완제의약품 개발 및 생산 역량 강화와 임상 공급망 확대를 위한 당사의 투자 현황을 확인...

Webinar
Addressing technical challenges in development drug products: A CDMO perspective
이 웨비나에서는 Thermo Fisher Scientific이 위탁 개발 중 기술적 난제 해결을 어떻게 지원해왔는지 자세히 소개합니다. 당사의 솔루션이 효과적인 의약품 개발과...

Webinar
Regulatory and cost implications for switching injectable delivery formats
다양한 주사 제형 옵션이 있으므로, 한 가지 형태의 고분자로 시판하고 나서 나중에 투여 형태를 바꾸기로 결정하는 것은 드문 일이 아닙니다. 이러한 일반적 관행은 종종 비용 절감 솔루션 및 공급 체인 연속성을 제공할 뿐만 아니라…
Article
Understanding the roles of solid-state characterization and crystallization within the product lifecycle
고형 활성약물성분(API)의 물리적 속성은 분리, 정제, 형태 제어에 이용되는 결정화 공정을 결정하고, 효과적인 제형 개발로 이어질 수 있게 합니다. ..
eBook
Protecting tomorrow: Supporting sustainability in the pharmaceutical and biotech industries
기후변화는 한계점에 도달해 있고 우리는 더 이상 지체할 시간이 없습니다. 상호 지속 가능한 여정을 성공적으로 맞이하기 위해서는 협업이 필수적입니다.

Whitepaper
Advancing drug development using in silico modeling
데이터는 지식이고, 지식은 곧 힘입니다. 그러나 지식은 실행 가능할 때만 힘이 됩니다. 예측 모델링은 견고한 신약 개발 및 제조 플랫폼을 개발하는데 도움이 될 수 있습니다..

Case study
We work together to meet global demand for COVID-19 vaccines
전 지구적 코로나19 팬데믹은 지난 2년 동안 전 세계를 근본적으로 뒤흔들어 놓았습니다. 공중보건 및 경제 위기를 초래한 팬데믹은 2차 세계대전 종전 이래 문명사회에 대한 최대 위협으로 기록되었습니다…

Case study
Delivering a large-scale product at a rapid pace
Thermo Fisher Scientific Pharma Service 팀은 고객이 다섯 단계의 까다로운 화학물질을 도입, 제조, 검증하여 3상 임상 개발 프로그램을 지원했습니다...

Brochure
Large molecule development and manufacturing: Comprehensive offering enabling speed and flexibility
당사의 통합형 및 맞춤형 서비스를 활용하면 복잡성을 제거할 수 있고 고분자 의약품을 보다 적은 비용과 낮은 위험으로 더 빠르게 출시할 수 있습니다...

Brochure
Steriles drug development and manufacturing: Flexibility and optimization
지난 5년간 무균 주사제 분야가 10% 급성장함에 따라 개발 및 제조 측면에서의 생산성 확대와 혁신적인 솔루션에 대한 필요성이 대두되었습니다. 복잡한 규제 환경 대응, 분석, 공정 개발 및 최적화, 정시 생산은 모두 무균 주사제의 성공적인 생산에 필수적인 요소입니다...

Brochure
Biologics Overview: Flexible Biomanufacturing Solutions
고객의 후보물질은 삶을 변화시키고 미래를 만들어갈 힘을 갖고 있습니다. Thermo Fisher Scientific은 고객의 성공을 가속화하고 동시에 최고 품질을 유지할 수 있도록 지원합니다...

Webinar
Accelerating your biologic’s development: From lab, to clinic, to market
Thermo Fisher Scientific이 신생 바이오기업의 임상 및 출시 기간 단축을 어떻게 지원하는지 알아보십시오. CDMO는 이제 성공적인 의약품 개발을 위한 필수 협력 파트너로 인식되고 있습니다.

Webinar
Preparing your biologic for commercialization: strategies to reduce risk and optimize outcomes
후기 전략을 잘 선택하여 일정과 생산량을 최적화하는 한편 변화하는 시장 상황에 대처할 수 있는 유연성을 유지하는 일은 바이오의약품을 개발하고 상용화하는 기업들에게는 큰 도전과제입니다.
Article
Patheon(파테온), “초기 개발 소요 시간 단축하는 혁신 솔루션 제공… 한국 바이오 제약 기업 성장 돕는다!”
에이빙 뉴스의 ‘Post 바이오코리아 특집 : 한-호주 간 비즈니스 기회를 잡아라’ 기사를 통해 당사의 호주 브리즈번 생산시설과 호주 정부기관과의 협업에 대해 확인하세요.
2022 Bio Korea
Thermo Fisher Scientific이 2022 BIO KOREA에 참여합니다.
일시: 2022년 5월 11일 ~ 13일
장소: 코엑스
부스번호: K10 Thermo Fisher Scientific

Biologics Manufacturing Korea 2022
Thermo Fisher Scientific이 BMK 2022에 참여합니다.
일시: 2022년 6월 29일 ~ 30일
장소: 인천 송도컨벤시아

2023 Bio Korea
Thermo Fisher Scientific이 2023 BIO KOREA에 참여합니다.
일시: 2023년 5월 10일 ~ 12일
장소: Coex Seoul
부스번호: N4 Thermo Fisher Scientific

Video
United with process & partnership
An experienced CDMO partner with an extensive network makes the difference when it comes to scale-up, tech transfer capabilities, and validation.

Video
United with capabilities & compassion
Is it possible to bring your molecule to medicine without a brick and mortar site and no testing labs or distribution capabilities?

Video
Thermo Fisher Scientific & CSL Enter Strategic Partnership to Provide Best-in-Class Pharma Services
We are pleased to announce that Thermo Fisher Scientific and global biotechnology company CSL have entered into a strategic partnership to help meet the growing demand for biologic therapies while also accelerating CSL’s broader manufacturing objectives.

Video
The Journey from Molecule to Medicine
It all starts with your discovery. A molecule, small or large, that needs a partner. Let Patheon be that partner.

Video
Continuous Manufacturing in Patheon’s Greenville, North Carolina Site
We are the first CDMO to build and manufacturing client product on a continuous manufacturing line. The suite, located at the site in Greenville, North Carolina, is custom built to utilize the best equipment available.

Expert
Christy Eatmon
Senior Staff Scientist, R&D
Scientific Expertise:
- Extensive experience in pre-clinical to early phase formulation development of sterile products
- Process engineering expertise to enable technology transfer and scale up of parenteral formulations
- High level knowledge of all phases from drug discovery to commercial manufacturing and commercial launch
- Extensive experience with both small and large molecules, including small molecule formulation for controlled release of poorly water-soluble drugs
Focus Area
Steriles
Credentials
Bachelor’s degree in chemistry from Moravian College in Pennsylvania

Expert
Paul Jorjorian
Vice President and General Manager, Biologics
Focus Area
Biologics (large molecule)

Expert
Elena Gontarz, PhD
Manager, Scientific and Technical Affairs
Focus Area
Biologics (large molecule)

Expert
Daniel Baskind
Manager, Scientific and Technical Affairs
Focus Area
Biologics (large molecule)

Expert
Frank Ritacco, PhD
Director, Scientific and Technical Affairs
Scientific Expertise:
- Highly experienced in the development of cell lines, media, and culture conditions for the production of recombinant proteins and naturalmetabolites, as well as bioreactor operation, scale-up, cGMP manufacturing and technology transfer
- Research experience and skills include both mammalian cell culture and microbial fermentation (bacteria, yeast, filamentous fungi), process development, cellular physiology, and perfusion culture
Focus Area
Biologics (large molecule)
Credentials
Doctor of Philosophy in microbiology and molecular genetics from Rutgers University, NJ
Master of Science in microbiology and molecular genetics from Rutgers University, NJ
Bachelor of Science in biological sciences from Cook College, Rutgers University, NJ

Expert
Jeff Hou, PhD
Director and Site Head, Scientific & Technical Affairs
Scientific Expertise:
- Biologics development
- Cell line development
- Process development
- Tech transfer
- GMP manufacturing
- Cell biology
- Lead candidate discovery
Focus Area
Biologics (large molecule)
Credentials
Doctor of Philosophy in biotechnology from The University of Queensland
Bachelor’s degree in advanced sciences from the University of New South Wales

Video
Bioprocessing Collaboration Center (BCC)
The new Bioprocessing Collaboration Center (BCC) in St. Louis, Missouri, uniquely positions Thermo Fisher to bring together industry-leading expertise in single-use technologies and biologics product development and manufacturing to deliver unmatched value to our customers.